米食品医薬品局(FDA)の諮問委員会は6日、 米製薬大手バイオジェン手掛けるアルツハイマー型認知症治療薬「アデュカヌマブ」について、症状の進行を遅らせる効果は証明されていないとする内容の勧告を出した。
4日に公表されたFDAのスタッフの報告書では、有効性を示す「非常に説得力のある」証拠が提供されたとの見解が示されていた。これを受けてバイオジェンの株価は4日に急騰した。
外部の専門家から成るFDAの諮問委員会は今回、同薬に対する懐疑的な見方を明確に示した。11人の委員のうち複数は、FDAスタッフの報告書について、バイオジェンにとって望ましい結果に偏向していると批判した。
焦点となったのは、アデュカヌマブに関する2つの試験で相反する結果が出た点。
諮問委は、2回目の大規模試験が明らかな失敗となる中、別の試験での成功が同薬の有効性を示す証拠として十分かという点について、否定的な見方を示した。
FDAスタッフは4日、2回目の試験が失敗でも、初期段階の試験で有効性が証明されているとしていた。
初期の認知症と診断された人の脳のアミロイド斑の水準に対する効果の有無については、5人の委員が肯定的な見解を示した。ただ、6人は「不確か」だとした。
諮問委の勧告に拘束力はなく、FDAが同薬を承認する可能性は依然としてある。
FDAは承認の可否について来年3月までに判断を下す見込み。
承認されれば、アルツハイマー型認知症治療薬としては数十年ぶりの新薬となる。
以上、
7月8日(エーザイリリース)
バイオジェンとエーザイは、アルツハイマー病(AD)治療薬候補であるアデュカヌマブについて、バイオジェンによる米国食品医薬品局(FDA)へのBiologics License Application(BLA:生物製剤ライセンス申請)の提出が完了したと発表した。
本申請完了はFDAとの継続的なコラボレーションによって実現できたものであり、臨床第Ⅲ相試験であるEMERGE試験およびENGAGE試験、ならびに臨床第Ⅰb相試験であるPRIME試験の臨床データに基づいている。
本承認申請完了の一環として、Priority Review(優先審査)を要請している。承認された場合、アデュカヌマブはADの臨床症状の悪化を抑制する初めての治療法となり、かつ脳内アミロイドベータ(Aβ)の除去が、臨床結果の改善をもたらすことを実証した初めての治療法となるとしていた。
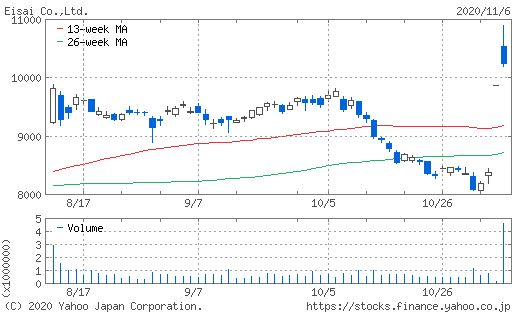
エーザイ株は6日出来高を伴いながら急騰した、その後米国で発表されたFDA諮問委員会報告
、5対6で効果は証明されていないとする判断、FDAにより承認される可能性も残るが・・・。

 バイオジェン&エーザイ AD薬「アデュカヌマブ」効果証明されずのFDA諮問委勧告
バイオジェン&エーザイ AD薬「アデュカヌマブ」効果証明されずのFDA諮問委勧告